Projektübersicht
Prof. Dr. Eva Friebertshäuser
Institut für Virologie
Philipps-Universität Marburg
Hans-Meerwein-Str. 2
35043 Marburg
Tel.: +49 (0)6421-28 66019
Fax: +49 (0)6421-28 68962
E-Mail: friebertshaeuser(at)staff.uni-marburg(dot)de

Hemmung virusaktivierender Wirtsproteasen
Projektbeschreibung
Die Reifespaltung viraler Hüllproteine durch Wirtsproteasen ist essentiell für die Infektiosität vieler humanpathogener Viren. Zahlreiche Oberflächenglykoproteine, u.a. hochpathogener aviärer Influenzaviren (z.B. H5N1), des Chikungunyavirus oder von Dengue-, West-Nil und Zika-Virus, werden durch furinartige Serinproteasen aktiviert. Andere Virusproteine, wie das Hämagglutinin zoonotischer H7N9 und saisonaler Influenza-A-Viren oder das Spike-Protein S vieler Coronaviren (CoV) werden durch die membranständige trypsinartige Serinprotease TMPRSS2 gespalten. Zuletzt konnten wir zeigen, dass das SARS-CoV-2 S sowohl durch Furin als auch TMPRSS2 aktiviert wird. Daher sind diese Wirtsproteasen vielversprechende Targets zur Entwicklung neuartiger antiviraler Wirkstoffe mit breitem Wirkungsspektrum.
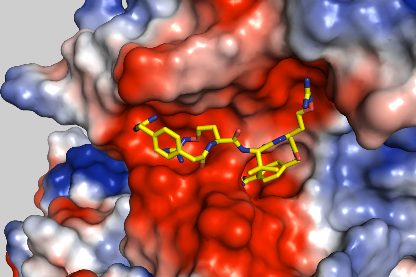
Kristallstruktur des Furins im Komplex mit Inhibitor MI-1851.

Kristallstruktur der TMPRSS2 überlagert mit den Inhibitoren MI-1904 (gelbe) und MI-432 (orange).
Wissenschaftliches Ziel:
Im Rahmen des Projekts sollen strukturbasiert hochwirksame Hemmstoffe der virusaktivierenden Wirtsproteasen Furin und TMPRSS2 entwickelt, charakterisiert und auf ihre antivirale Wirksamkeit in Zellkultur und im Tiermodell geprüft werden.
DRUID-Kooperationspartner:
A1 Becker lab, A2 Grünweller lab, B6 Herker lab, C1 Hildt lab
Literatur D1: 1. Böttcher et al. (2006) J Virol 80: 9896-8 3. Becker et al. (2012) J Biol Chem 287: 21992-03 4. Böttcher-Friebertshäuser et al. (2012) Vaccine 30: 7374-80 5. Ivanova et al. (2017) ChemMedChem 12: 1953-68 6. Lam van et al. (2019) ChemMedChem 14, 673-85 7. Bestle et al. (2020) LSA 3: e202000786 8. Bestle et al. (2021) J Virol 95: e0090621 9. Lam van et al. (2021) ACS Med Chem Lett 12: 426-32.
