D1: Hemmung virusaktivierender Wirtsproteasen
Prof. Dr. Eva Friebertshäuser
Institut für Virologie
Philipps-Universität Marburg
Hans-Meerwein-Str. 2
35043 Marburg
Tel.: +49 (0)6421-28 66019
Fax: +49 (0)6421-28 68962
E-Mail: friebertshaeuser(at)staff.uni-marburg(dot)de
Prof. Dr. Thorsten Steinmetzer
Institut für Pharmazeutische Chemie
Philipps-Universität Marburg
Marbacher Weg 10
35032 Marburg
Tel.: +49 (0)6421-28 25900
Fax: +49 (0)6421-28 25901
E-Mail: torsten.steinmetzer(at)staff.uni-marburg(dot)de
Projektbeschreibung
Die Reifespaltung viraler Hüllproteine durch Wirtsproteasen ist essentiell für die Infektiosität vieler humanpathogener Viren. Zahlreiche Oberflächenglykoproteine, u.a. hochpathogener aviärer Influenzaviren (z.B. H5N1), des Chikungunyavirus oder von Dengue-, West-Nil und Zika-Virus, werden durch furinartige Serinproteasen aktiviert. Andere Virusproteine, wie das Hämagglutinin zoonotischer H7N9 und saisonaler Influenza-A-Viren oder das Spike-Protein S vieler Coronaviren (CoV) werden durch die membranständige trypsinartige Serinprotease TMPRSS2 gespalten. Zuletzt konnten wir zeigen, dass das SARS-CoV-2 S sowohl durch Furin als auch TMPRSS2 aktiviert wird. Daher sind diese Wirtsproteasen vielversprechende Targets zur Entwicklung neuartiger antiviraler Wirkstoffe mit breitem Wirkungsspektrum.
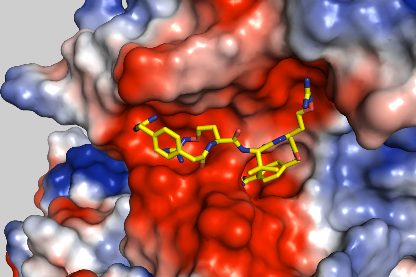
Kristallstruktur des Furins im Komplex mit Inhibitor MI-1851.

Kristallstruktur der TMPRSS2 überlagert mit den Inhibitoren MI-1904 (gelbe) und MI-432 (orange).
Wissenschaftliches Ziel:
Im Rahmen des Projekts sollen strukturbasiert hochwirksame Hemmstoffe der virusaktivierenden Wirtsproteasen Furin und TMPRSS2 entwickelt, charakterisiert und auf ihre antivirale Wirksamkeit in Zellkultur und im Tiermodell geprüft werden.
DRUID-Kooperationspartner:
A1 Becker lab, A2 Grünweller lab, B6 Herker lab, C1 Hildt lab
Literatur D1: 1. Böttcher et al. (2006) J Virol 80: 9896-8 3. Becker et al. (2012) J Biol Chem 287: 21992-03 4. Böttcher-Friebertshäuser et al. (2012) Vaccine 30: 7374-80 5. Ivanova et al. (2017) ChemMedChem 12: 1953-68 6. Lam van et al. (2019) ChemMedChem 14, 673-85 7. Bestle et al. (2020) LSA 3: e202000786 8. Bestle et al. (2021) J Virol 95: e0090621 9. Lam van et al. (2021) ACS Med Chem Lett 12: 426-32.


