Projektbereich D:
D1Hemmung virusaktivierender Wirtsproteasen
Eva Friebertshäuser, Torsten Steinmetzer
Prof. Dr. Eva Friebertshäuser
Institut für Virologie
Philipps-Universität Marburg
Hans-Meerwein-Str. 2
35043 Marburg
Tel.: +49 (0)6421-28 66019
Fax: +49 (0)6421-28 68962
E-Mail: friebertshaeuser(at)staff.uni-marburg(dot)de
Prof. Dr. Thorsten Steinmetzer
Institut für Pharmazeutische Chemie
Philipps-Universität Marburg
Marbacher Weg 10
35032 Marburg
Tel.: +49 (0)6421-28 25900
Fax: +49 (0)6421-28 25901
E-Mail: torsten.steinmetzer(at)staff.uni-marburg(dot)de
Projektbeschreibung
Die Reifespaltung viraler Hüllproteine durch Wirtsproteasen ist essentiell für die Infektiosität vieler humanpathogener Viren. Zahlreiche Oberflächenglykoproteine, u.a. hochpathogener aviärer Influenzaviren (z.B. H5N1), des Chikungunyavirus oder von Dengue-, West-Nil und Zika-Virus, werden durch furinartige Serinproteasen aktiviert. Andere Virusproteine, wie das Hämagglutinin zoonotischer H7N9 und saisonaler Influenza-A-Viren oder das Spike-Protein S vieler Coronaviren (CoV) werden durch die membranständige trypsinartige Serinprotease TMPRSS2 gespalten. Zuletzt konnten wir zeigen, dass das SARS-CoV-2 S sowohl durch Furin als auch TMPRSS2 aktiviert wird. Daher sind diese Wirtsproteasen vielversprechende Targets zur Entwicklung neuartiger antiviraler Wirkstoffe mit breitem Wirkungsspektrum.
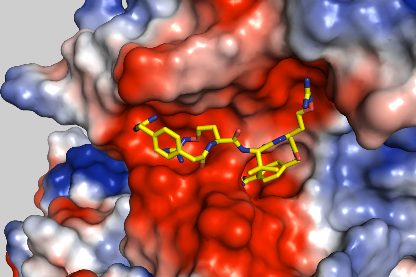
Kristallstruktur des Furins im Komplex mit Inhibitor MI-1851.

Kristallstruktur der TMPRSS2 überlagert mit den Inhibitoren MI-1904 (gelbe) und MI-432 (orange).
Wissenschaftliches Ziel:
Im Rahmen des Projekts sollen strukturbasiert hochwirksame Hemmstoffe der virusaktivierenden Wirtsproteasen Furin und TMPRSS2 entwickelt, charakterisiert und auf ihre antivirale Wirksamkeit in Zellkultur und im Tiermodell geprüft werden.
DRUID-Kooperationspartner:
A1 Becker lab, A2 Grünweller lab, B6 Herker lab, C1 Hildt lab
Literatur D1: 1. Böttcher et al. (2006) J Virol 80: 9896-8 3. Becker et al. (2012) J Biol Chem 287: 21992-03 4. Böttcher-Friebertshäuser et al. (2012) Vaccine 30: 7374-80 5. Ivanova et al. (2017) ChemMedChem 12: 1953-68 6. Lam van et al. (2019) ChemMedChem 14, 673-85 7. Bestle et al. (2020) LSA 3: e202000786 8. Bestle et al. (2021) J Virol 95: e0090621 9. Lam van et al. (2021) ACS Med Chem Lett 12: 426-32.
D2HEV, Identifizierung zellulärer Targets für antivirale Strategien – Hemmung der Virusfreisetzung durch Modulation des Cholesterolspiegels
Kai-Henrik Peiffer, Stefan Zeuzem, Eberhard Hildt
Dr. Kai-Henrik Peiffer
Goethe-Universität Frankfurt am Main
Universitätsklinikum
Zentrum der Inneren Medizin
Medizinische Klinik I
Theodor-Stern-Kai 7
60596 Frankfurt am Main
E-Mail: kai-henrik.peiffer(at)kgu(dot)de
Prof. Dr. Eberhard Hildt
Bundesinstitut für Impfstoffe
und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Straße 51-59
63225 Langen
Tel.: +49 (0)6103-77 2140
Fax: +49 (0)6103-77 1234
E-Mail: Eberhard.Hildt(at)pei(dot)de
Prof. Dr. Stefan Zeuzem
Department of Medicine
Goethe University Hospital
Theodor-Stern-Kai 7
60590 Frankfurt am Main
Tel.: +49 (0)69-6301 4544
E-Mail: zeuzem(at)em.uni-frankfurt(dot)de
Projektbeschreibung
Das Hepatitis E Virus führt jährlich zu über 20 Mio. Infektionen weltweit und betrifft Industrienationen, besonders allerdings Entwicklungsländer. Limitierte Behandlungs-optionen sind häufig mit schweren Nebenwirkungen verbunden. Da das unbehüllte Virus für seine Freisetzung endosomale Prozesse nutzt, bietet dies einen vielversprechenden Ansatzpunkt für neue Wirkstoffe. Im Rahmen der ersten Förderungsperiode wurde besonders die lysosomale Degradation von HEV im endosomalen System als zentraler Ankerpunkt antiviraler Aktivität identifiziert. Nebst angeborener Immunantwort spielt hierbei die zelluläre Cholesterolhomöostase eine essenzielle Rolle. Basierend darauf, sollen zugrundeliegende Regulationen besser charakterisiert werden, um den Weg für Drug-Repurposing Verfahren zu bereiten und neue, assoziierte Zielstrukturen zu identifizieren. Eine Erweiterung der bisherigen Systeme soll via Tiermodell auch auf die adaptive Immunantwort abzielen, um ein breites, klinisches Bild zu erhalten.
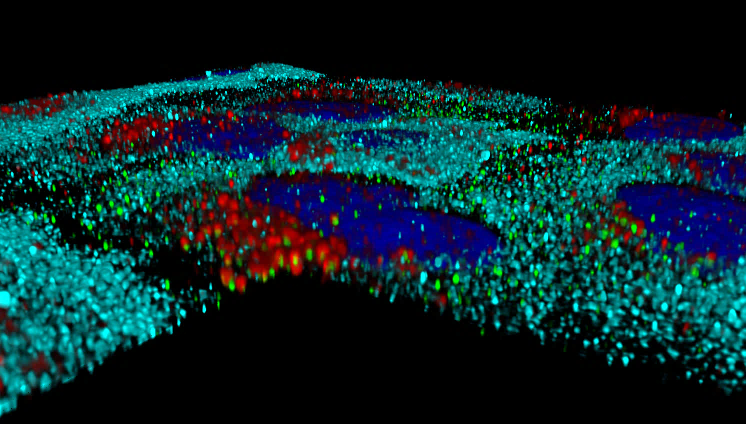
Dreidimensionale Rekonstruktion von HEV (grün) , GBP1 (cyan) und Lysosomen (rot) nach Behandlung mit Interferon .
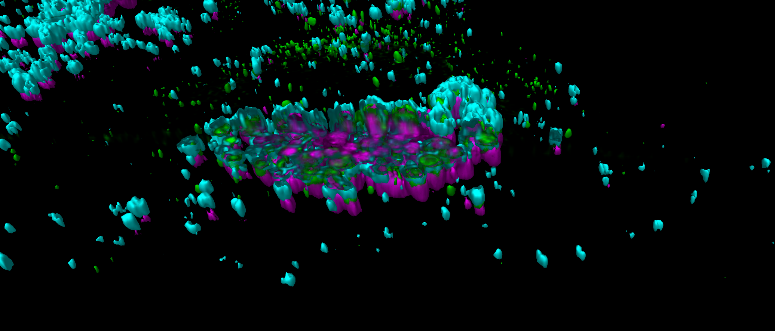
Mittels CLSM erfasste, dreidimensionale Rekonstruktion von HEV (grün) in Lysosomen (cyan) nach Induktion einer Cholesterolakkumulation (magenta).
Wissenschaftliches Ziel:
Inhibition des endosomalen Lebenszyklus des HEV durch Modulation Cholesterol-abhängig regulierter Zielstrukturen mittels Applikation geeigneter Wirkstoffe („drug repurposing“).
DRUID-Kooperationspartner:
A2 Grünweller lab, A4 Heine/Reuter lab, B1 Diederich/Kolb lab, B6P Herker lab, C5 Glebe/Geyer lab, D1 Steinmetzer lab
Literatur D2: [1] Glitscher et al. (2018) Viruses 10(6):301; [2] Müller et al. (2020) Antiviral Res 174:104706; [3] Basic et al. (2019) Antiviral Res 172:104644; [4] Glitscher et al. (2021) J Virol doi: 10.1128/JVI.01564-20; [5] Glitscher et al. (2021) Cell Mol Gastroenterol Hepatol, doi:10.1016 /j.jcmgh.2021.02.002; [6] Himmelsbach et al. (2018) Emerg Microbes Infect 7(1):196. [7] Glitscher et al. (2021) Cell Microbiol. 16:e13379
D3Charakterisierung apoptotischer Parasiten zur Identifizierung neuer Zielmoleküle für die Behandlung von Leishmaniose
Ger van Zandbergen
Prof. Dr. Ger van Zandbergen
Abteilung Immunologie
Paul-Ehrlich-Institut
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel.: +49 (0)6103-77 2005
E-Mail: Ger.Zandbergen(at)pei(dot)de
Projektbeschreibung
Leishmaniose ist eine vernachlässigte Tropenkrankheit, die durch den Parasiten Leishmania spp. verursacht wird und in fast 100 Ländern endemisch ist. Wir konnten zeigen, dass apoptotische Leishmania major (L. major) Promastigoten sowohl für die Infektiosität als auch das Überleben von Parasiten in den Wirtszellen verantwortlich sind. Apoptotische Parasiten induzieren eine anti-inflammatorische Antwort in humanen Makrophagen, die zu keiner effektiven T-Zellantwort gegen Leishmanien führt. Auch wenn L. major Parasiten alle typischen Apoptose-Merkmale zeigen, sind jedoch typische eukaryotische Apoptose-regulierende Proteine in Leishmanien nicht vorhanden.
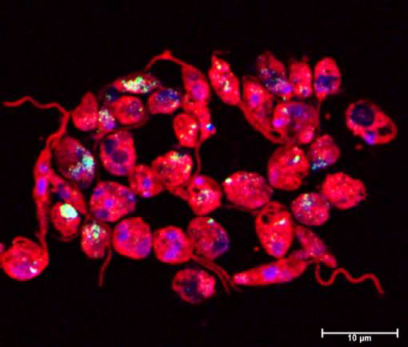
Färbung fragmentierter DNA (TUNEL staining) in L. major Cas9/T7, in denen durch Miltefosin Apoptose induziert wurde. (TUNEL: grün; DAPI: blau; anti-Lm-Serum: rot. ©Ger van Zandbergen)
Wissenschaftliches Ziel:
Für einen neuartigen Impfansatz und zur Tötung der Parasiten möchten wir zur Apoptose-regulierende Proteine in Leishmanien als mögliche neue Medikamenten-Targets identifizieren sowie attenuierte Leishmanien-Stämme ohne anti-inflammatorische Eigenschaften.
DRUID-Kooperationspartner:
B1 Kolb, B3 Rahlfs/Kolb, E3 Rahlfs/Przyborski
Literatur D3: 1. Arens et al. (2018) Front Immunol 31(9):1772. 2. Crauwels et al. (2019) Front Immunol 22(10):2697. Further publications within DRUID: 3. Turoňová et al. (2020) Science 370(6513):203-208.
D4Inhibition der Glutaminolyse und Glycolyse zur Hemmung der C. parvum-Infektion sowie One Health-Studie zur Kryptosporidiose in Kamerun
Carlos Hermosilla, Anja Taubert, Sybille Mazurek
Prof. Dr. Sybille Mazurek
Institut für Veterinär-Physiologie und -Biochemie
Fachbereich Veterinärmedizin
Justus-Liebig-Universität Gießen
Frankfurter Str. 100
35392 Gießen
Tel.: + 49 (0)641-99 38182
E-Mail Sybille.Mazurek(at)vetmed.uni-giessen(dot)de
Prof. Dr. Carlos Hermosilla
Institut für Parasitologie/Institut für Veterinär-Physiologie und -Biochemie
Justus-Liebig-Universität Gießen
Schubertstr. 81/Frankfurter Str. 100
Tel.: +49 (o)641-99 38461/99 38182
E-Mail: Carlos.R.Hermosilla(at)vetmed.uni-giessen(dot)de
Prof. Dr. Anja Taubert
BFS, Institut für Parasitologie
Justus-Liebig-Universität Gießen
Schubertstraße 81
35392 Gießen
Tel.: +49 (0)641-99 38460
Fax: +49 (0)641-99 38469
E-Mail: Anja.Taubert(at)vetmed.uni-giessen(dot)de
Projektbeschreibung
Kryptosporidien sind parasitäre Durchfallerreger beim Menschen, die insbesondere in Entwicklungsländern bei Kleinkindern und HIV-Infizierten zu hohen Morbiditäten und Todesfällen führen. Dabei sind die genauen infektionsbedingten Zusammenhänge in diversen Entwicklungsländern, wie z. B. Kamerun, nicht vollständig untersucht. Zur Therapie der Risikogruppen sind derzeit keine effektiven Medikamente erhältlich. Kryptosporidien sind obligat intrazelluläre Protozoen und verfügen selbst nur über minimale eigene Stoffwechselkapazitäten, daher müssen sie den Stoffwechsel der Wirtszelle zu ihrem Vorteil modulieren, um sich intrazellulär zu vermehren. Über die Charakterisierung der metabolischen Signaturen C. parvum-infizierter Wirtszellen konnten wir Stoffwechselreaktionen und -wege der Wirtzelle identifizieren, die für die Parasitenvermehrung essenziell sind.

Cryptosporidium parvum- (gelb) infizierte Wirtszellen (Zellkerne: blau), tomografische Mikroskopie © Juan Vélez
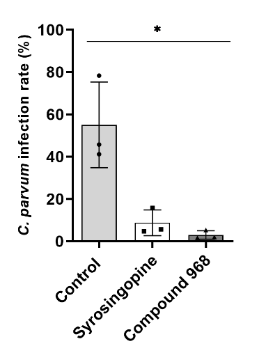
Hemmung von Cryptosporidium parvum über Stoffwechselinhibitoren (Vélez et al. 2021c)
Wissenschaftliches Ziel:
Das Projekt zielt darauf ab, strategische Angriffspunkte im Stoffwechsel der Wirtszelle (v. a. Glykolyse, Glutaminolyse) über neue Inhibitoren oder Kombinationsbehandlungen zu blockieren und damit indirekt die Parasitenentwicklung zu hemmen. Daneben wird eine One-Health-Studie zur Kryptosporidiose in Kamerun unter Berücksichtigung diverser epidemiologisch wichtiger Parameter durchgeführt.
DRUID-Kooperationspartner:
E4 Spengler lab
Literatur D4: 1. *Vélez et al. (2021a) Pathogens 11(1):49. 2. * Vélez et al. (2021b) Biology 10(10):963 3. ** Vélez et al. (2021c) Biology 10(1):60








