Projektbereich C:
C1Targets für antivirale Strategien gegen das Zika Virus
Daniela Bender, Eberhard Hildt
Dr. Daniela Bender
Paul-Ehrlich-Institut
Bundesinstitut für Impfstoffe
und biomedizinische Arzneimittel
Paul-Ehrlich-Straße 51-59
63225 Langen
Tel.: +49 (0)6103-77 5411
E-Mail: Daniela.Bender(at)pei(dot)de
Prof. Dr. Eberhard Hildt
Bundesinstitut für Impfstoffe
und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Straße 51-59
63225 Langen
Tel.: +49 (0)6103-77 2140
Fax: +49 (0)6103-77 1234
E-Mail: Eberhard.Hildt(at)pei(dot)de
Projektbeschreibung
Zika-Viren (ZIKV) sind Arboviren aus der Familie der Flaviviren. Im Zuge der ZIKV Epidemie 2015/2016 hat die WHO am 01.02.2016 den Ausbruch in Südamerika zum Public Health Emergency of International Concern (PHEIC) erklärt, da es einen Zusammenhang zwischen der Zika-Virus-Infektion Schwangerer und dem Auftreten von Mikrozephalien bei Neugeborenen gibt. Derzeit steht weder eine Impfung noch eine spez. Therapie zur Verfügung. Durch Hemmung der Virusreplikation bereits in der frühen Phase der Infektion ggf. mittels einer temporären präventiven Strategie könnte die Viruslast deutlich reduziert und so die Verbreitung des Virus und so auch das Risiko einer intrauterinen Infektion vermindert werden. Im Rahmen der ersten Förderperiode konnten Zielstrukturen für antivirale Ansätze identifiziert werden.
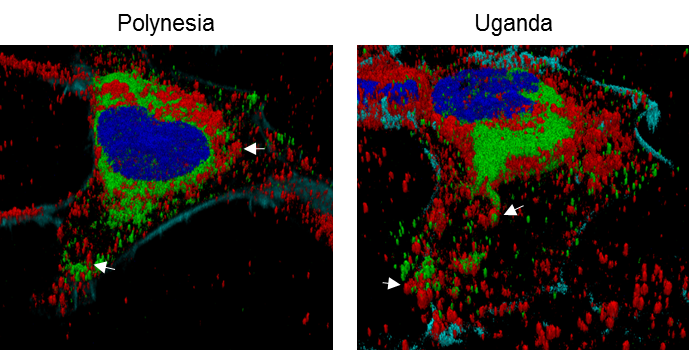
Intrazelluäre Verteilung von Tetherin (rot) und dem ZIKV Hüllprotein E (grün) in Zellen infiziert mit zwei verschiedenen ZIKV Isolaten (Uganda bzw. Polynesia)
Wissenschaftliches Ziel:
Basierend auf bereits identifizierten Zielstrukturen und weiterer Zielstrukturen sollen antivirale Strategien entwickelt, der Mechanismus charakterisiert und deren Wirkung auch auf weitere Flaviviren untersucht werden.
DRUID-Kooperationspartner:
A2 AG Grünweller, B1 AG Diderich/Kolb, B6P AG Herker, C2 AG Kempf, C5 AG Glebe/Geyer, D1 AG Steinmetzer, E6 AG Schiffmann/Laux
Literatur C1: 1. Herrlein et al. (2021) J Virol. doi: 10.1128/jvi.02117-2 2. Sabino et al (2021)., J Virol. doi: 10.1128 3. *Maddaluno et al., 2020 EMBO Mol Med. doi: 10.15252/emmm.201911793 4. Basic et al. 2019 Antiviral Res. doi: 10.1016/j.antiviral.2019.104644. 5. Akhras et al. (2019) Viruses doi: 10.3390/v11080748. 6. Sabino et al., (2019) doi: 10.3390/v11060524 7. Elgner et al (2018) Viruses doi: 10.3390/v10040149
C2Bartonella bacilliformis Pathogenitätsfaktoren als diagnostische und therapeutische Targets
Volkhard Kempf
Prof. Dr. Volkhard A. J. Kempf
Universitätsklinikum Frankfurt
Institut für Medizinische Mikrobiologie
und Krankenhaushygiene
Goethe-Universität Frankfurt/Main
Paul-Ehrlich-Str. 40
60596 Frankfurt/Main
Tel.: +49 (0)69-6301 5019
Fax: +49 (0)69-6301 83431
E-Mail: volkhard.kempf(at)kgu(dot)de
Projektbeschreibung
Bartonella bacilliformis ist der Erreger der Carrión-Krankheit, eine in den Anden Südamerikas endemisch vorkommende und vektorübertragene Infektionserkrankung. Infektionen mit B. bacilliformis führen zu einem schweren hämolytischen Fieber mit hoher Letalität. Die Inhibition der bakteriell vermittelten Hämolyse stellt einen vielversprechenden Therapieansatz dar. Zwei Pathogenitätsfaktoren spielen bei der Hämolyse eine zentrale Rolle, von denen mindestens eines ein potentielles drug target darstellt. Bislang ist der Mensch der einzig bekannte Reservoir-Wirt für B. bacilliformis und es wird angenommen, dass asymptomatisch Infizierte die Quelle neuer Ausbrüche sind. Die Identifizierung asymptomatischer Träger ist daher von besonderer Bedeutung für die Infektionskontrolle. Hierfür wurde eine Alphaversion eines B. bacilliformis IgG ELISAs und Lineblots entwickelt.

Rasterelektronen-mikroskopie eines, durch B. bacilliformis, infizierten Erythrozyten.
B. bacilliformis NovaLisa® KIT.
Wissenschaftliches Ziel:
Ziel des Projektes ist es, die beiden Pathogenitätsfaktoren in Hinblick auf Hämolyse zu untersuchen, um neue Antivirulenzstrategien zu entwickeln. Die Alphaversion des B. bacilliformis IgG ELISAs und Lineblots soll, in Kooperation mit unseren Partnern aus Lima/Peru, in Feldstudien evaluiert werden.
DRUID-Kooperationspartner:
A7 Przyborski, C1 Bender / Hildt, E7 Locker, Gold Standard Diagnostics (früher NovaTec)
Literatur C2: [1] Garcia-Quintanilla et al. (2019) Parasites&Vectors 12(1):141, [2] Riess et al. (2004) J Exp Med 200:1267-78, [3] Dichter et al. (2019) Microbiology Res Announc, DOI: 10.1128/MRA.01377-19, [4] Dichter et al. (2021) Lancet Microbe 2:e685–94.
C3Komplement-interagierende Proteine von Rückfallfieberborrelien
Peter Kraiczy
Prof. Dr. Peter Kraiczy
Goethe-Universität Frankfurt/Main
Institut für Medizinische Mikrobiologie und Krankenhaushygiene
Universitätsklinikum Frankfurt
Paul-Ehrlich-Str. 40
60596 Frankfurt am Main
Tel.: +49 (0)69-6301 7165
Fax: +49 (0)69-6301 83431
E-Mail kraiczy(at)em.uni-frankfurt(dot)de
Projektbeschreibung
Borrelia recurrentis zählt zu den „neglected arthropod-borne pathogens“ und ist der Erreger des epidemischen Läuserückfallfiebers, das unbehandelt eine Mortalität von bis zu 40% aufweist. Die hämatogene Ausbreitung des Erregers lässt auf effiziente Strategien der Immunevasion schließen, um insbesondere dem Komplementsystem, zu entgehen. Dabei spielen Komplement-interagierende Proteine eine bedeutende Rolle. Mit Hilfe von bioinformatischen Analysen wurde ein Cluster von fünf Proteinen identifiziert, die auf unterschiedlichen Aktivierungsstufen das Komplementsystem inhibieren. Diese Proteine stellen vielversprechende Kandidaten für die Entwicklung von in vitro-Diagnostika dar. Zwei Testsysteme (Line immunoblot und ELISA) zur Diagnose des epidemischen Läuserückfallfiebers wurden bereits entwickelt und evaluiert.
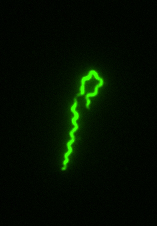
Immunfluoreszenz-mikroskopische Aufnahme von B. recurrentis.
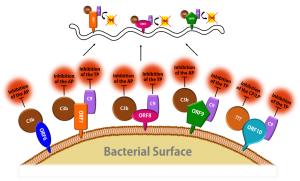
Schematische Darstellung der Komplementinaktivierung auf der Oberfläche von B. recurrentis.
Wissenschaftliches Ziel:
Der Fokus dieses Projektes liegt auf der funktionellen und strukturellen Charakterisierung weiterer Komplement-inhibierender Proteine von Borrelia recurrentis sowie der Optimierung der bestehenden Testsysteme und der Entwicklung eines point-of-care Antigen-Schnelltests.
DRUID-Kooperationspartner:
B2 Ziebuhr lab, C2 Kempf lab, C4 Steinhoff lab, D1 Steinmetzer lab, E3 Rahlfs/Przyborski, Gold Standard Diagnostics (früher NovaTec)
Literatur C3: [1] Cordes et al. (2005) Nat Struct Mol Biol 12:276-277; [2] Röttgerding et al. (2017) Sci Rep 7:303; [3] Nguyen et al. (2018) Front Cell Infect Microbiol. 8:23; [4] Walter et al. (2019) Front Immunol 10:2722; [5] Röttgerding and Kraiczy (2020) Front Immunol 11:1560; [6] Schmidt et al. (2021) Sci Rep 11:4964.
C4Verbesserte Diagnose und Behandlung der viszeralen Leishmaniose
Ulrich Steinhoff
Prof. Dr. Ulrich Steinhoff
Institut für Medizinische Mikrobiologie und Krankenhaushygiene
Philipps-Universität Marburg
Hans-Meerwein-Straße 2
35043 Marburg
Tel.: +49 (0)6421-28 66134
Fax: +49 (0)6421-58 66420
E-Mail: ulrich.steinhoff(at)staff.uni-marburg(dot)de
Projektbeschreibung
Die zuverlässige Diagnose sowie Behandlung der an viszeraler Leishmaniose (VL) erkrank-ten Menschen und Hunden (Reservoirwirt) ist für die Kontrolle dieser Infektion wichtig. Derzeit verfügbare diagnostische Tests, die auf der Antikörperreaktion mit dem Kinesin-protein von Leishmanien basieren, zeigen in manchen Endemiegebieten eine schlechte Sensitivität. Wir haben ein Kinesinantigen (rKLi8.3) entwickelt und patentiert, dass bei Mensch und Tier eine verbesserte diagnostische Leistung aufweist. Dies war möglich, indem wir ein Kinesinantigen mit optimierter Struktur (Repeats) und Sequenz entwickelt haben. Derzeit werden verschiedene Testformate mit rKLi 8.3 hergestellt und geprüft.
Die Behandlung der VL ist hinsichtlich von Wirksamkeit und Nebenwirkungen sehr proble-matisch. Es wurde ein Inhibitor (GNF-6702) der selektiv das Proteasom der Kinetoplastida (T. brucei, T. cruzei und L. donovani) inhibiert entwickelt. GNF-6702 bindet an eine Proteasomenuntereinheit von Kinetoplastida, die sich vom Menschen strukturell unter-scheidet. Die spezifische Bindung an das Kinetoplastenproteasom scheint ursächlich für die sehr geringe Toxizität in Säugerzellen zu sein. Wir konnten zeigen, dass die proteaso-male beta 4 Untereinheit bei allen bisher getesteten Leishmanienisolaten konserviert ist und sich somit als therapeutisches Ziel eignet.
Wissenschaftliches Ziel:
Im Projektteil Diagnose produzieren und überprüfen wir in Zusammenarbeit mit unserem Industriepartner verschiedene Formate eines sero-diagnostischen VL-Schnelltest. Im Projektteil Behandlung validieren wir in Zellkultur-experimenten Spezifität, Wirkung und Toxizität neuer, Kinetoplastida-spezifischen Proteasomen Inhibitoren.
DRUID-Kooperationspartner:
B1 Diederich/Kolb Labor, C2 Kempf Labor, D3 van Zandbergen Labor
Literatur C4: [1] Abass et al. (2013) PLoS Negl Trop Dis. 18;7; [2] Abass et al. (2015) PLoS One. 3;10; [3] Martínez Abad et al. (2017) Acta Trop. 166:133-138; [4] Pereira et al. (2020) Eur J Microbiol Immunol 27;10:165-171. [5] Khare et al. (2016) Nature 537: 229-233
C5Hit-to-Lead Entwicklung selektiver HBV/HDV Entry-Inhibitoren
Joachim Geyer, Dieter Glebe
Prof. Dr. Joachim Geyer
Institut für Pharmakologie und Toxikologie
Justus-Liebig-Universität Gießen
Schubertstraße 81
35392 Gießen
Phone: +49 (0)641-99 38404
E-Mail: joachim.m.geyer(at)vetmed.uni-giessen(dot)de
Prof. Dr. Dieter Glebe
Institut für Medizinische Virologie
Justus-Liebig-Universität Gießen
Schubertstraße 81
35392 Gießen
Phone: +49 (0)641-99 41246
E-Mail: dieter.glebe(at)viro.med.uni-giessen(dot)de
Projektbeschreibung
Infektionen mit den Hepatitis B (HBV) und D (HDV) Viren sind die Hauptursache für hepatozelluläres Karzinom und Leberzirrhose infolge chronischer Hepatitis. Obwohl ein wirksamer prophylaktischer Impfstoff zur Verfügung steht sind die therapeutischen Möglichkeiten insbesondere für HDV beschränkt. Die Entwicklung von HBV/HDV Entry-Inhibitoren könnte hier Abhilfe schaffen. Diese sollten spezifisch den HBV/HDV Rezeptor NTCP (einen physiologischen Gallensäuretransporter in der Leber) blockieren. Bisher wurden mehr als 200 Verbindungen aus verschiedenen Substanzklassen getestet und entsprechende 3D-Struktur-Wirkungsmodelle (QSAR) generiert. Des Weiteren wurde ein Pharmakophor-Modell für HBV/HDV Entry-Inhibitoren etabliert. Mit diesen Modellen wurden bereits virtuelle Substanzbibliotheken durchmustert und dabei weitere wirksame Hits identifiziert.
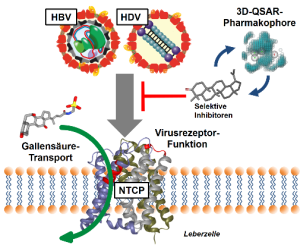
NTCP ist ein physiologischer Gallensäuretransporter in der Plasmamembrane von Leberzellen. NTCP ist aber auch der hepatische Rezeptor für HBV und HDV. HBV/HDV Entry-Inhibitoren sollten selektiv die Virusrezeptorfunktion von NTCP blockieren. 3D-QSAR- und Pharmacophor-Modelle helfen neue wirksame Verbindungen zu identifizieren.
Wissenschaftliches Ziel:
Entwicklung niedermolekularer oral bioverfügbarer HBV/HDV Entry-Inhibitoren, welche in der Lage sind selektiv die Virusrezeptorfunktion von NTCP zu blockieren, ohne dabei dessen physiologische Gallensäuretransportfunktion zu beeinträchtigen. Erste Hits sollen mittels molekularem Wirkstoffdesign zu Leitstrukturen weiterentwickelt werden.
DRUID-Kooperationspartner:
B1 Diederich/Kolb, B3 Rahlfs/Kolb/van Zandbergen, D2 Pfeiffer/Zeuzem/Hildt, E3 Rahlfs/Przyborski, E6 Schiffmann/Laux
Literatur C5: 1. *Kirstgen et al. (2020) Sci Rep 10:21772 2. *Grosser et al. (2021) Front Mol Biosci 8:689757 3. *Kirstgen et al. (2021) Viruses 13:666 4. *Kirstgen et al. (2021) Viruses 13:1489. 5. Paraskevopoulou et al. (2020) Proc Natl Acad Sci USA 117(30).
C6Das Fasciola-Kinom als Quelle für neue Wirkstofftargets
Simone Häberlein
PD Dr. Simone Häberlein
Justus-Liebig-Universität Gießen
BFS, Institut für Parasitologie
Schubertstraße 81
35392 Gießen
Tel.: +49 (0)641-99 38476
Fax: +49 (0)641-99 38469
E-Mail: Simone.Haeberlein(at)vetmed.uni-giessen(dot)de
Projektbeschreibung
Proteinkinasen regulieren eine Vielzahl zellulärer Prozesse und stellen vielversprechende Ziele für Medikamente dar, nicht nur in der Krebstherapie sondern auch gegen parasitäre Infektionserreger. Beide Erkrankungen haben u.a. gemein, dass Stammzellen eine besondere Rolle beim Wachstum spielen. Unsere Hypothese ist, dass die Inhibierung ausgewählter Proteinkinasen als Therapieansatz gegen den Leberegel Fasciola hepatica genutzt werden kann, einem weltweit vorkommenden Zoonose- und NTD-Erreger. Im Rahmen des Projektes werden (1) potentielle Wirkstoffziele im Fasciola-Kinom bioinformatisch identifiziert und genetisch validiert, (2) gegen den Leberegel aktive Kinase-Inhibitoren identifiziert, sowie (3) die Wirkungsweise von Kinase-Inhibitoren mit biochemischen und bildgebenden Methoden charakterisiert.
U.a. haben wir in Kooperation mit der AG Spengler (Projekt E4) den Einsatz der bildgebenden AP-MALDI-Massenspektrometrie für “Drug Imaging” in Parasiten-gewebe etabliert und können so Aufnahmeroute, -kinetik und Wirkstofftropismus von Kinase-inhibitoren in Leberegeln unter-suchen.
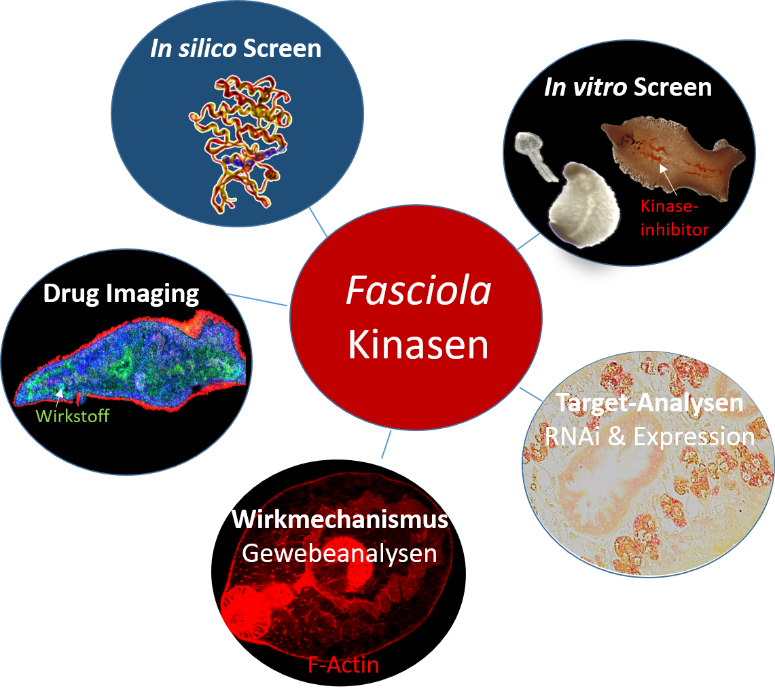
Strategie zur Identifizierung von Proteinkinase-Inhibitoren als Wirkstoffkandidat gegen den Leberegel Fasciola hepatica. ©Simone Häberlein
Wissenschaftliches Ziel:
Ziel des Projekts ist es, Proteinkinase-Inhibitoren als neue Wirkstoff-kandidaten gegen Fasciolose zu finden.
DRUID-Kooperationspartner:
A2 Grünweller lab, B4 Schlitzer lab, B5 Grevelding lab, B7 Falcone lab, E4 Spengler lab
Literatur C6: 1. Houhou et al. (2019) Sci Rep 9:15867. 2. Li et al. (2019) Parasitol Res 118(3):881-890. 3. Morawietz et al. (2020) Front Vet Sci 7:611270. 4. Mokosch et al. Anal Bioanal Chem 413(10): 2755-2766. 5. Morawietz et al. (2022) Parasitol Res (online ahead of print) doi: 10.1007/s00436-021-07388-1








