B4: Schistosoma mansoni: Biologische Zielstrukturen und Inhibitorentwicklung
Prof. Dr. Christoph Grevelding
BFS, Institut für Parasitologie
Justus-Liebig-Universität Gießen
Schubertstraße 81
35392 Gießen
Tel.: +49 (0)641-99 38466
Fax: +49 (0)641-99 38469
E-Mail: Christoph.Grevelding(at)vetmed.uni-giessen(dot)de
Projektbeschreibung
Hintergrund: Beim dem human- und tierpathogenen Wurmparasiten Schistosoma mansoni hängt die sexuelle Reifung des Weibchens von einem kontinuierlichen Paarungskontakt mit dem Männchen ab (Abb. 1). Die Paarung ist somit auch für die Produktion von Wurmeiern und der daraus resultierenden Pathogenese der Schistosomiasis entschei-dend. Wir haben gezeigt, dass verschiedene Molekülklassen in diese Reproduktionsprozesse involviert sind.1 So offenbarten Versuche mit Kinaseinhibitoren und RNA-Interferenz gegen Kinasen, dass diese Moleküle Zellteilungsaktivität, Spermatogenese, Oogenese, Eiproduk-tion und Vitalität von Würmern in vitro negativ beeinflussen. Der Abl-TK-Inhibitor Imatinib (Krebsmedikament Glivec) induzierte in adulten S. mansoni eine gestörte Reproduktion sowie die Ablösung der Gastro-dermis mit letalen Folgen.2,3
Neben Kinasen, die wir in Kooperation mit der AG Falcone bearbeiten4, stehen weitere Enzyme im Fokus unserer Untersuchungen. Dazu zählen Aldehyddehydrogenasen (ALDH) und Aldehydreduktasen (AR), die durch molekularen Stress induzierte Prozesse in Schistosomen regulieren. Ihre Inhibition könnte den Parasiten schwächen. Erste in vitro-Experimente mit Inhibitoren gegen diese Moleküle, wie z.B. dem ALDH-Inhibitor Disulfiram, führten in kurzer Zeit zu morphologischen Veränderungen, Entpaarung, reduzierter Vitalität sowie zum Tod des Parasiten in vitro. Aber auch Helikasen können interessante Angriffspunkte darstellen, wie Arbeiten mit dem RNA-Helikase-Inhibitor Silvestrol gezeigt haben.5 In adulten S. mansoni reduzierte Silvestrol die Fitness adulter Würmer in vitro und die Stammzellproliferation in Keimzellen (Abb. 2). Mit den AGs Prof. Schlitzer und Prof. Grünweller (Marburg) werden wir an diesen Zielmolekülen arbeiten und an der Entwicklung synthetischer Inhibitoren6,7, um physiologische und morphologische Effekte in vitro und bei Topkandidaten dann im Infektionsmodell in vivo zu untersuchen.

Abb. 1. Lichtmikroskopische Aufnahme eines Schistosomen-Pärchens in vitro. Während des dauerhaften Paarungskontaktes liegt das Weibchen (Pfeil) in einer Bauchfalte des Männ-chens. Das ist eine wesentliche Voraussetzung für die Eiproduk-tion (Sterne).
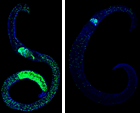
Abb. 2. EdU-Färbung von S. mansoni-Weibchen vor (links) und nach Silvestrol-Behandlung (rechts). Die Anzahl der Stammzellen (grün) ist signifikant redu-ziert (rechts).
Wissenschaftliches Ziel:
Wir werden die Klonierung sowie die molekulare und biochemische Charakterisierungen zweier RNA-Helikasen aus S. mansoni durchführen. Unterstützt durch verschiedene Kooperationspartner/innen im DRUID-Konsortium (s.u.) werden wir die rekombinanten Proteine in Enzymassays gegen Silvestrol und synthetische Derivate testen. Ferner planen wir, mit den bereits rekombinant hergestellten Enzymen SmALDH312 und SmAR, weitere potenzielle Zielmoleküle, Enzymtests mit Inhibitoren durchzuführen. Hierzu zählen u.a. Disulfiram-derivate, die bereits anti-schistosomale Effekte in vitro gezeigt hatten. Experimenten zur Kristallisationen und Strukturaufklärungen dieser Moleküle werden auch durchgeführt. Ziel ist die Entwicklung von Wirkstoffen mit inhibitorischer Aktivität gegen die ausgewählten Zielproteine, hoher Spezifität und Bioverfügbarkeit bei gleichzeitig reduzierter Toxizität.8 In vitro– und später auch in vivo-Experimente sollen die Übertragbarkeit der gewonnenen Erkenntnisse auch auf andere Parasiten zeigen (Plattformprojekt E1).
DRUID-Kooperationspartner:
A2 AG Grünweller, B3 AG Rahlfs/Kolb/van Zandbergen, B5 AG Schlitzer, E1 Platformprojekt/Häberlein, E3 AG Rahlfs/Przyborski, E5 AG Czermak/Salzig lab
Literatur B4: 1Beckmann et al. (2010) PLoS Pathog 6:e1000769; 2Beckmann et al. (2010) Int J Parasitol 40:521-6; 3Beckmann et al. (2012) Curr Pharm Des 18:3579-94; 4Moreira et al. (2022) Molecules (in press); 5Taroncher-Oldenburg et al. (2021) Microorganisms 9(3):540; 6Peter Ventura et al. (2021) ChemMedChem 14(21):1856-62; 7Peter Ventura et al. (2012) Arch Pharm (Weinheim) 354(12):

